La découverte des propriétés insecticides du DDT en 1939 avait suscité de grands espoirs dans la lutte contre le paludisme à l’échelle mondiale. Ces espoirs ont persisté pendant plusieurs années, mais se sont finalement estompés lorsque les effets néfastes du DDT sur l’environnement et la santé ont été mis en évidence.
Plus de 60 ans après, malgré de nombreux efforts, et des résultats conséquents, le paludisme demeure toujours un fardeau préoccupant pour de nombreux pays à travers le monde. En 2021 encore, on estimait à 619 000 le nombre de décès dus au paludisme dans 85 pays, dont principalement des pays africains[i], rappelant sans cesse les défis persistants dans la lutte contre cette maladie. La découverte d’un vaccin efficace serait l’ultime victoire dans cette lutte incessante contre le paludisme, offrant enfin un espoir tangible de contrôle et d’éradication à long terme.
En 2021, le vaccin RTS, S/AS01, premier vaccin contre le paludisme et premier vaccin jamais développé contre un parasite affectant l’Homme, a été approuvé par l’OMS, après plus de 20 années de recherche et d’essais cliniques. Deux ans après, R21 un autre vaccin est approuvé et ajouté à la liste de vaccins préqualifiés par l’OMS. L’espoir suscité par ces vaccins n’est pas sans rappeler celui qu’avait suscité le DTT quelques décennies plutôt.
Il ne fait en effet aucun doute que ces deux vaccins représentent des véritables prouesses scientifiques et seront des outils précieux dans la lutte contre le paludisme, cependant, il est important de rester prudent quant à l’optimisme excessif sur leur impact potentiel[ii]. De nombreux aspects de ces vaccins présentent encore des défis importants.
Le vaccin RTS S n’est pas le vaccin « Idéal »
Le Malaria Vaccine Technology Roadmap, un cadre stratégique de recherche et de développement (R&D), avait défini en 2013 une vision stratégique pour le futur vaccin contre le paludisme 2030. Celui-ci devrait, selon les objectifs, avoir une efficacité protectrice d’au moins 75% contre le paludisme clinique, être adapté à l’administration aux groupes à risque dans les régions endémiques, et réduire considérablement la transmission du parasite et l’incidence de l’infection palustre chez l’homme[iii].
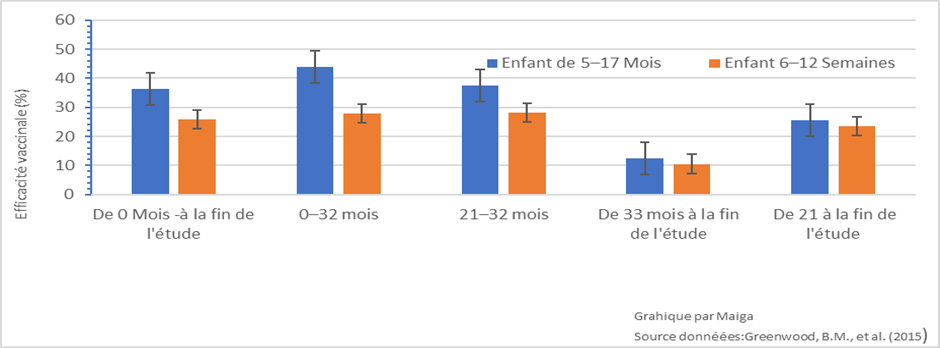
Cependant, le premier vaccin antipaludique autorisé, le RTS, S, n’a pas pleinement atteint ces objectifs ambitieux. La première grande étude clinique sur le vaccin RTSS réalisée dans 7 pays a montré une efficacité modérée, autour de 40% contre le paludisme clinique chez les jeunes enfants sur une période de suivi de 3 à 4 ans[iv]. Les analyses statistiques suggèrent que l’efficacité du vaccin était initialement plus élevée (60 et 40 % à 3 mois pour les enfants et les nourrissons, respectivement), mais qu’elle diminuait rapidement pour atteindre une efficacité limitée à partir de 18 mois[v]. De plus, son impact sur la transmission n’est pas aussi important que souhaité, puisque le vaccin RTS S ne cible pas les stades sexuels du parasite pour empêcher la transmission du parasite aux moustiques. Néanmoins, il existe un espoir avec le vaccin R21, qui a une efficacité de plus de 70% et suggère qu’il est possible d’atteindre les objectifs ambitieux du Malaria Vaccine Technology Roadmap. Aussi, bien que l’efficacité du RTS S soit inférieure aux objectifs, des études de modélisation prédisent qu’il permettrait d’éviter un nombre substantiel de cas cliniques et d’épisodes graves de paludisme. En 2023 l’OMS a rapporté que ce vaccin a pu réduire de 13 % le nombre de décès (toute cause) chez les jeunes enfants au Kenya.
Ils ne peuvent être considérés comme des vaccins’’ Autonomes’’.
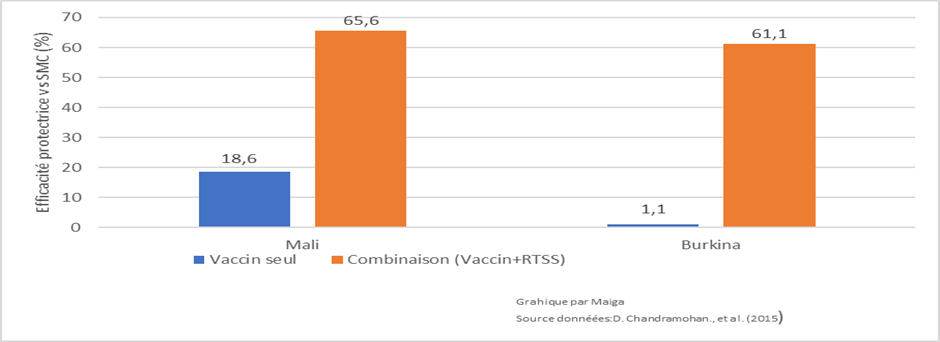
Il serait erroné de considérer les vaccins RTS, S et R21, comme des « vaccins autonomes ». En effet, leur efficacité démontrée dans les essais cliniques est fortement liée au fait qu’ils ont été évalués avec d’autres stratégies de lutte antipaludique ou dans des environnement ou d’autres stratégies étaient déjà en place, comme la chimioprophylaxie saisonnière, l’utilisation de moustiquaires imprégnées d’insecticide et les pulvérisations intra domiciliaires. Les vaccins antipaludiques doivent être associés à d’autres interventions pour être pleinement efficaces. Dans une étude menée au Mali et Burkina Faso, l’approche combinée, RTSS Chimioprévention, semble plus efficace pour réduire la charge globale de paludisme que le vaccin seul. Comparée à la chimioprévention seule, l’efficacité protectrice de l’association (RTSS+Chimioprévention) était de 62,8% (IC 95% : 58,4 à 66,8) mais seulement de 7.98% (IC 95% : −1.0 à 16.0) lorsque le vaccin seul était utilisé[i].
De même dans l’étude réalisée au Burkina Faso qui a révélé l’efficacité du vaccin R21, plus de 80% de tous les participants dormaient sous moustiquaires imprégnée et avaient reçu au moins une dose de la chimioprévention palustre saisonnière[ii].
Ces vaccins, comme toutes les stratégies de lutte contre le paludisme, doivent être intégrés dans une approche de lutte antipaludique plus large et ne peuvent être considérés comme des solutions autonomes.
Figure 2 : Efficacité protectrice, du vaccin RTS S seul ou en combinaison comparée à la chimioprévention seule (ces pourcentages d’efficacité sont comparatifs et relatifs à la SMC)
Défis majeurs pour un déploiement à grande échelle
Comme pour tous les vaccins, la recherche, la fabrication et la distribution à grande échelle jusqu’aux populations les plus reculées (les plus touchées aussi) coûtent chères et nécessitent des investissements importants. Il n’existe toujours pas de stratégie assez efficace de production à grande échelle d’un outil d’une importance vitale pour la santé de millions de personnes qui n’ont pas les moyens de le payer. Comme le souligne Aurélia Nguyen, Chef de programme, GAVI, « Qui va payer pour cela et pour combien de temps ? »[i]. Il y a aussi la question de l’acceptabilité et l’adhésion des communautés aux programmes de vaccination antipaludique. Et enfin il y a la question de l’intégration des vaccins antipaludiques dans des nombreux pays touchés par le paludisme confronté à des systèmes de santé fragiles et qui peinent déjà à déployer efficacement d’autres vaccins plus établis contre d’autres maladies.
Risque de complaisance et nécessité de maintenir les efforts existants.
Les vaccins RTSS et R21 lorsqu’ils seront déployés à grande échelle auront des impacts conséquents sur l’incidence du paludisme. Il a été démontré qu’une baisse significative de l’incidence du paludisme pourrait s’accompagner d’un relâchement des efforts de lutte antipaludique et ensuite d’une résurgence des cas de paludisme[ii]. Cette complaisance se traduit généralement par une diminution de la priorité accordée au paludisme dans les programmes de santé publique et un réinvestissement des ressources dans d’autres priorités sanitaires. Lorsque la pression exercée par la maladie diminue, les vecteurs anophèles regagnent du terrain et les systèmes de surveillance et de riposte peuvent s’affaiblir avec des conséquences sanitaires parfois désastreuses.
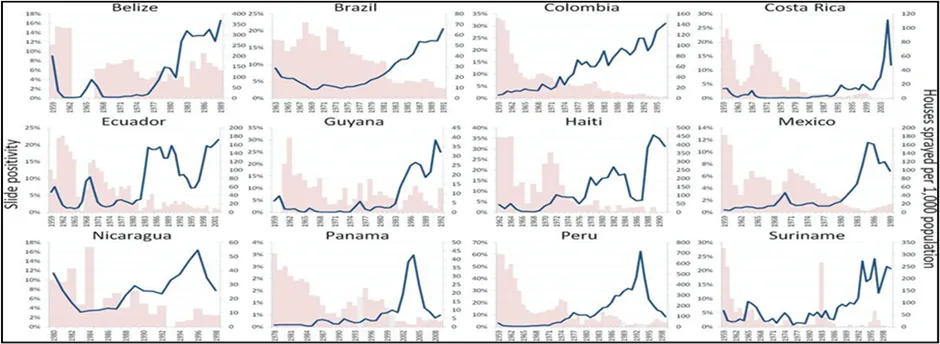
Figure 3 La résurgence du paludisme en Amérique latine semble fortement corrélée avec l’affaiblissement des programmes de pulvérisation intra domiciliaire (PID) [75]. La ligne bleue représente la positivité des frottis (axe de gauche) et les barres roses indiquent le nombre de maisons traitées par la PID pour 1 000 habitants [54, 79]. Les barres grises représentent les moyennes des années environnantes lorsqu’il n’y avait pas de données sur la PID disponibles pour une année donnée (sinon l’absence de barre indique que zéro maison n’a été pulvérisée). Source : Justin M Cohen
Bien que les vaccins contre le paludisme constituent une avancée scientifique notable, de nombreuses questions persistent quant à leur durabilité et leur mise en œuvre à grande échelle. Des efforts de recherche soutenus seront nécessaires pour relever ces défis et faire progresser la lutte contre cette maladie dévastatrice.
————————–
ii https://www.nytimes.com/2022/10/04/health/malaria-vaccines.html
iii Malaria Vaccine Funders Group. Malaria Vaccine Technology Roadmap. 2013.
viii Malaria Vaccine Rollout to Africa Is a Cautionary Tale – The New York Times (nytimes.com)
Veillez au besoin consulter d’autres articles similaires qui pourraient vous intéresser …