Bien que nécessaire pour la diffusion du savoir, le système de publication scientifique montre parfois des lacunes en termes de rigueur et de contrôle. Cette fragilité révèle les limites d’un mécanisme censé assurer la qualité et la crédibilité des recherches. Des cas flagrants comme l’ajout d’un enfant mineur comme coauteur [1],la manipulation d’images ou l’affiliation fictive à des institutions [2], montrent que la publication d’un article ne garantit pas nécessairement la rigueur scientifique. L’affaire Sokal et d’autres scandales récents en sont des exemples frappants[3].
En 1996, Alan Sokal, professeur de physique à l’Université de New York, soumet un article dont le titre volontairement absurde était, « Transgresser les frontières : vers une herméneutique transformative de la gravitation quantique ». L’objectif était simple : prouver que des absurdités peuvent être publiées, si elles sont habillées de jargon et de formules complexes. Le canular fut un succès et devint un signal d’alarme sur le manque de rigueur dans certaines revues. En 2018, un nouveau scandale appelé l’ « affaire Sokal au carré » relance le débat : trois chercheurs parviennent à publier des articles vides de sens comme, l’analyse d’une culture du viol chez les chiens dans les parcs, dans des revues académiques, démontrant une fois de plus la vulnérabilité du système.
Le domaine de la santé publique n’est pas moins épargné par les méconduites méthodologiques. Une étude a montré que le nombre d’articles rétractés pour faute méthodologique a été multiplié par 19 entre 2001 et 2010, la majorité de ces fautes étant des fraudes conscientes [4]. Heureusement, depuis quelques années, une nouvelle communauté de détectives scientifiques indépendants, jusque-là méconnue, analyse de près certaines découvertes spectaculaires de leurs collègues et permet de mettre en lumière leurs insuffisances[5][6].
Parmi les exemples récents de méconduite méthodologiques figurent l’étude sur l’efficacité de la plante Artemisia annua contre le paludisme et l’étude sur l’efficacité de l’hydroxychloroquine (HCQ) contre le covid19, toutes retractées respectivement en 2020[7] et 2024[8]. Bien que réalisées à des périodes et dans des contextes différents, les deux études présentent des failles méthodologiques similaires, révélées par des experts en épidémiologie et intégrité scientifique[9][10][11]
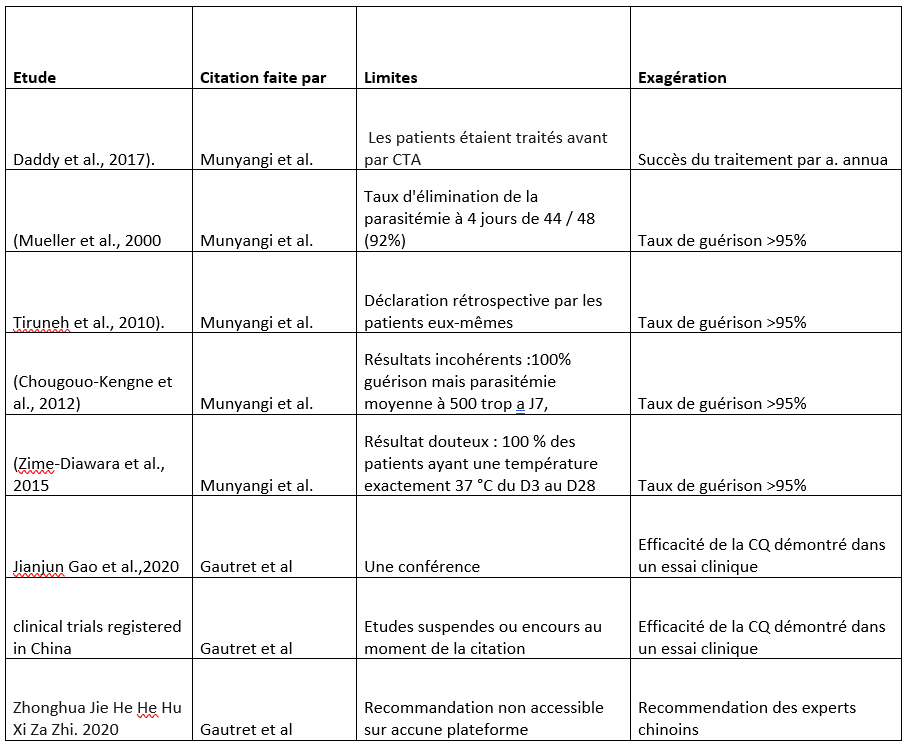
Exagération des preuves disponibles sur l’efficacité des molécules testées :
Les études sur la chloroquine contre le COVID-19 (Gautret et al.) et sur l’Artemisia annua contre le paludisme (Munyangi et al.) partagent plusieurs caractéristiques. Toutes deux reposent largement sur des citations biaisées ou mal interprétées, tirées d’études dont les limites méthodologiques sont souvent ignorées. Elles surestiment systématiquement l’efficacité des traitements expérimentaux en s’appuyant sur des données incomplètes, des déclarations anecdotiques ou des résultats incohérents. De plus, les auteurs omettent de nuancer leurs conclusions et présentent des résultats préliminaires comme des preuves définitives.
Absence de randomisation :
Les essais cliniques contrôlés sont considérés comme le « gold standard » de la preuve scientifique en santé publique. Mais c’est la randomisation qui en constitue véritablement la colonne vertébrale, car elle garantit la validité causale des résultats. Elle consiste à répartir les participants de façon aléatoire entre deux (ou plusieurs) groupes recevant des interventions différentes[12][13].
Pourquoi randomiser ? Parce que si l’expérimentateur choisissait lui-même à qui administrer un traitement, il pourrait inconsciemment privilégier des patients moins gravement atteints, faussant ainsi les résultats. La randomisation élimine ce biais de sélection en assurant, en moyenne, une répartition équilibrée des caractéristiques connues et inconnues entre les groupes. Il existe plusieurs méthodes pour assurer la randomisation dans un essai clinique. Dans l’étude de Munyangi et al., les auteurs ont opté pour une méthode où les patients eux-mêmes tiraient au sort le traitement qu’ils allaient recevoir. Cette approche peut être valide si elle respecte les principes de l’allocation à l’aveugle ,c’est-à-dire que ni le patient ni le personnel soignant ne doivent être en mesure d’identifier à l’avance quel traitement est attribué. Cependant, cette condition est difficile à respecter dans ce cas précis : le groupe traité recevait une infusion de feuilles d’Artemisia, tandis que le groupe témoin recevait des comprimés classiques antipaludiques. Il est donc probable que les aspects visuels ,comme la taille, la couleur ou la consistance des préparations, aient permis d’identifier le traitement administré, compromettant ainsi l’aveuglement .
Même souci méthodologique dans l’étude de Gautret et al. Le groupe contrôle n’a pas été constitué par randomisation, mais comprenait des patients provenant d’autres centres médicaux ou ayant refusé de recevoir le traitement actif.
Problèmes liés l’éthique et à la transparence :
Les deux études présentent des manquements méthodologiques et éthiques, bien que de nature différente. L’étude de Munyangi et al. disposait d’une taille d’échantillon suffisante pour produire des résultats robustes. Toutefois, mener un essai à grande échelle sans preuves préalables solides de l’efficacité du traitement pour une maladie aussi grave que le paludisme, alors que des traitements éprouvés existent déjà, constitue une violation éthique majeure. À l’inverse, l’étude de Gautret et al., bien que de petite taille, a avancé des conclusions fortes sur l’efficacité d’un traitement à partir de données très limitées, ce qui soulève également des questions éthiques sérieuses.
Par ailleurs, les deux travaux posent problème sur le plan de la conformité administrative. Dans le cas de Gautret et al., l’étude aurait été approuvée par les autorités réglementaires françaises le 5 mars 2020, et par le comité d’éthique le 6 mars, pour un suivi des patients jusqu’au 14e jour. Or, l’article a été soumis pour publication le 16 mars, ce qui rend difficilement compatible un suivi complet de 14 jours réalisé après approbation éthique. Cela laisse planer un doute sur un éventuel démarrage de l’étude avant l’obtention des autorisations requises.
Une autre violation dans cette étude concerne le consentement des participants. Les patients du bras de control étaient les participant qui n’avait pas donné leur consentement pour le bras actif.
Quant à l’étude de Munyangi, un manque de transparence a été relevé dans l’enregistrement du protocole : le numéro communiqué correspondait à celui d’un essai antérieur mené par les mêmes auteurs sur une autre pathologie. Ce flou entretient une incertitude sur la rigueur et la traçabilité de l’étude.


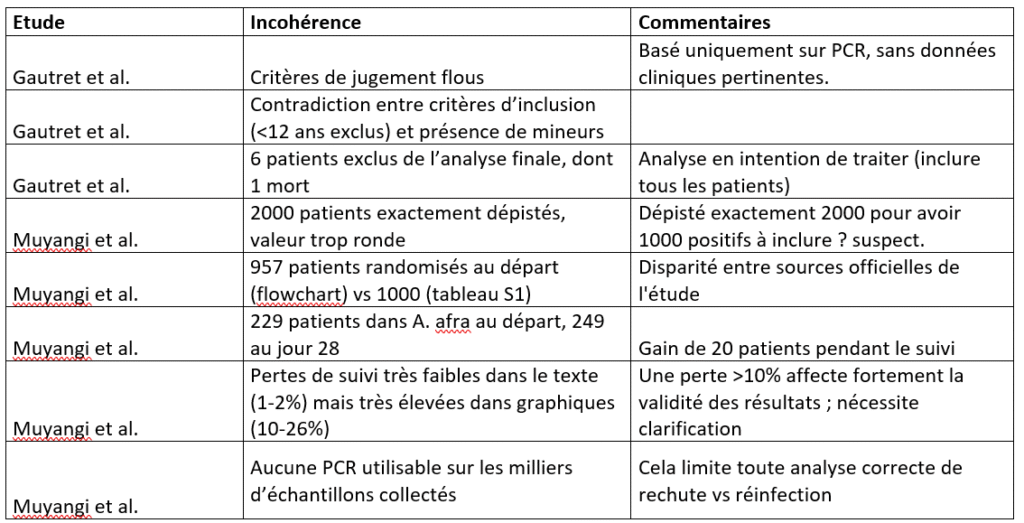
Résultats incohérents.
Les études de Munyangi et Gautret semblent partager aussi des problèmes sérieux au niveau des résultats. Incohérences internes, résultats non justifiés, critères flous : les deux études laissent de nombreuses questions sans réponse. Chez Gautret et al., les critères de jugement reposaient uniquement sur le test PCR, sans données cliniques sur l’évolution des symptômes ou la guérison réelle des patients. Le protocole mentionnait un suivi de 14 jours, mais les résultats publiés ne couvrent que six jours, laissant planer un doute sur la cohérence du calendrier. Pire encore, six patients du groupe traité ont été exclus de l’analyse finale, dont un est décédé, ce qui remet en cause la transparence et la validité statistique de l’étude. Du côté de Munyangi et al., des écarts troublants apparaissent entre le nombre de patients randomisés au départ et ceux rapportés à la fin de l’étude. Certains groupes voient même leur effectif augmenter au fil du temps, une anomalie difficilement explicable dans un essai clinique rigoureux. L’impossibilité d’exploiter les tests PCR sur les milliers d’échantillons collectés prive l’étude d’une évaluation fiable des rechutes ou réinfections. Ces manquements cumulatifs minent la crédibilité des résultats rapportés et soulignent l’importance de la rigueur dans la conduite et l’analyse des essais cliniques.
Conclusion
Ces deux études, celle de Munyangi sur l’Artemisia annua et celle de Gautret sur l’hydroxychloroquine, illustrent les dangers d’une recherche conduite avec manque de rigueur ou parti pris. Derrière des apparences scientifiques, elles cumulent des biais méthodologiques, des incohérences dans les résultats et des violations éthiques préoccupantes. Si certaines erreurs peuvent relever de l’inattention ou du contexte d’urgence, d’autres traduisent une fragilité plus profonde du système de production et de validation des connaissances. Ces dérives ne sont pas anecdotiques : elles compromettent la confiance du public, exposent les patients à des risques injustifiés, et détournent les ressources de la santé publique.
Pourtant face aux critiques, les auteurs ont préféré agiter l’opinion en dénonçant un complot orchestré par des puissances occultes, industrie pharmaceutique et autres, plutôt que de répondre aux objections méthodologiques. Ce qui menace la santé publique, c’est bien la promotion de pseudo-sciences conduites hors des standards méthodologiques et éthiques .
Ces deux cas doivent servir de leçon : il ne suffit pas de publier pour faire science, il faut démontrer, prouver et respecter les principes fondamentaux de la recherche.
Références
[5] A once-ignored community of science sleuths now has the research community on its heels
[8] Second Most-Cited Paper To Ever Be Withdrawn Finally Retracted After 4-Year Controversy | IFLScience
[12] Friedman, L. M., Furberg, C. D., & DeMets, D. L. (2010). Fundamentals of Clinical Trials (4th ed.). Springe
[13] Schulz, K. F., Altman, D. G., & Moher, D. (2010). CONSORT 2010 Statement: Updated Guidelines for Reporting Parallel Group Randomised Trials. BMJ, 340, c332.